Qué es la Terapia de Reemplazo Génico (GRT) y cómo funciona.
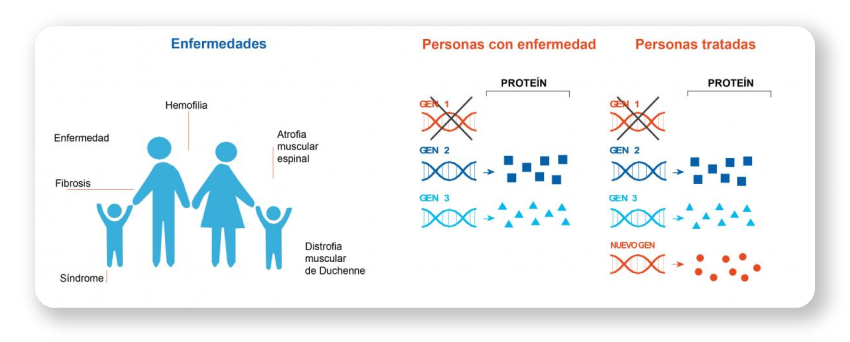
La GRT es un tipo de terapia génica que aborda la causa raíz de una enfermedad genética al reemplazar la función de un gen faltante o defectuoso con una nueva copia funcional del gen para restaurar la función de la proteína1,2,3.
Cómo funciona la GRT1,2
Enfermedades genéticas.
Las enfermedades genéticas implican defectos en el funcionamiento de los genes, que están formados por ADN y producen proteínas, grandes moléculas complejas necesarias para la estructura y función de los tejidos y órganos1,4.
Algunas enfermedades genéticas son monogenéticas, lo que significa que son causadas por un defecto heraditario en un solo gen, por lo que son candidatos ideales para terapia de reemplazo génico1,4.
Vectores de virus adenoasociados (AAV)
La GRT se logra con el uso de un vector, a menudo un virus diseñado para transportar un gen humano funcional en lugar de una enfermedad2.
Se han desarrollado y estudiado varios vectores para optimizar el proceso de entrega de genes, pero los virus adenoasociados (AAV) han surgido entre los más favorables. Por lo que se sabe, los AAV no causan enfermedades en humanos, y tienen la capacidad de1,2,3,5:
- Transferir material genético en el núcleo de la célula.
- Ingresar en células que se dividen y que no se dividen.
- Apuntar a una variedad de células, incluidas las del sistema nervioso central.
Una cepa de AAV llamada AAV9 también tiene la capacidad única de cruzar la barrera hematoencefálica3.
Avances en Terapia Génica
El concepto de terapia génica se introdujo en la década de 1970, y en 1985 se demostró por primera vez que era efectiva para corregir un defecto genético en células humanas1,6. Después de décadas de desarrollo, la investigación en terapia génica ahora se considera uno de los campos de investigación más prometedores y activos en medicina. En 2017, la Administración de Alimentos y Medicamentos de EE. UU. aprobó la primera terapia génica para un tipo de pérdida de visión raro y hereditario7. A medida que avanza la investigación en terapia génica, crece su potencial para ayudar a los pacientes con otras enfermedades genéticas.
Referencias:
1. Global Genes. A Guide to Gene Therapy. https://globalgenes.org/wp-content/uploads/2016/03/Guide-to-Gene-Therapy.... Accessed April 19, 2018. 2. NIH. How does gene therapy work? https://ghr. nlm.nih.gov/primer/therapy/procedures. Accessed April 19, 2018.
2. NIH. How does gene therapy work? https://ghr. nlm.nih.gov/primer/therapy/procedures. Accessed April 19, 2018.
3. Saraiva J, Nobre RJ, Pereira de Almeida L. Gene therapy for the CNS using AAVs: the impact of systemic delivery by AAV9. J Control Release. 2016;241:94- 109.
4. National Human Genome Research Institute. FAQ about Genetic Disorders. https://www.genome.gov/19016930/faq-about-genetic-disorders/. Accessed March 13, 2018.
5. Gray S, Woodard K, Samulski R. Viral vectors and delivery strategies for CNS gene therapy. Therapeutic Delivery. 2010;1(4):517-534.
6. National Center for Biotechnology Information. Gene Therapy 2017: Progress and Future Directions. https://history.nih.gov/exhibits/ genetics/sect4.htm. Accessed April 27,2018.
7. U.S. Food and Drug Administration. FDA approves novel gene therapy to treat patients with a rare form of inherited vision loss. https://www.fda.gov/NewsEvents/Newsroom/ PressAnnouncements/ucm589467.htm. Accessed April 19, 2018.
8. Hastie E and Jude Samulski R. Adeno-Associated Virus at 50: A Golden Anniversary of Discovery, Research, and Gene Therapy Success— A Personal Perspective. Hum Gene Ther. 2015 May 1; 26(5): 257–265.
9. Freidmann T, Roblin R. Gene therapy for human genetic disease? Science. 1972;175(4025):949-955
10. Muul LM, Tuschong LM, Soenen SL, et al. Persistence and expression of the adenosine deaminase gene for 12 years and immune reaction to gene transfer components: long-term results of the first clinical gene therapy trail. Blood. 2003;101(7):2563-2569.
11. Keeler A, ElMallah M, Flotte T. Gene therapy 2017: progress and future directions. Clin Transl Sci. 2017;10(4):242-248
12. Zhang WW, Li L, Li D, et al. The first approved gene therapy product for cancer ad-p53 (Gendicine): 12 years in the clinic. Hum Gen Ther. 201829(2):160-179.
13. Glybera (Alipogene tiparvovec) Summary of Product Characteristics (SmPC). Amsterdam, the Netherlands: uniQure Biopharma BV. 2012.
14. FDA approval brings first gene therapy to the United States [news release]. Bethesda, MD. US Food and Drug Administration; August 30, 2017. https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm574058.htm. Accessed January 29, 2018.
15. FDA approves novel gene therapy to treat patients with a rare form of inherited vision loss [news release]. US Food and Drug Administration; December 19, 2017. https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ ucm589467.htm. Accessed January 29, 2018. Accessed January 29, 2018.
16. Ginn S, et al. Gene therapy clinical trials worldwide to 2012 — an update. J Gene Med. 2013;15:65-77. US-UNB-18-0169 enero 2019